炎症性肠病 (IBD) 是一种病因不明的非特异性肠道炎性疾病,主要包括克罗恩病和溃疡性结肠炎。IBD会导致腹泻、腹痛、便血、体重减轻等症状,目前很难根治。临床治疗以糖皮质激素类、水杨酸类和免疫抑制类等药物为主,仅能缓解临床症状,效果不佳且容易复发,长期使用会抑制全身免疫系统,增加患者感染,甚至患某些癌症的风险。炎症性肠病患者的肠道微环境会发生改变,包括肠道菌群失衡以及活性氧 (ROS) 水平升高,导致肠道黏膜损伤。通过清除ROS与调节肠道菌群平衡相结合的策略,恢复健康的肠道微环境,有望从根本上治疗炎症性肠病。近日,来自威斯康星大学麦迪逊分校的胡全银教授团队在Science Advances上发表了题为Mucoadhesive probiotic backpacks with ROS nanoscavengers enhance the bacteriotherapy for inflammatory bowel diseases的最新研究成果:借助益生菌的肠道定植能力递送ROS纳米清除剂到达肠道部位,延长其肠道滞留时间并增强其ROS清除能力;同时在益生菌表面包裹具粘附作用的保护膜,增强益生菌的环境抵抗力和肠道粘附力,调节肠道菌群平衡,通过肠道菌群调节和ROS清除两方面共同作用有效改善肠道微环境,增强炎症性肠病的治疗效果。首先,为清除过量积累的ROS,作者设计合成了具有ROS清除能力的脂溶性分子PPS,并与透明质酸 (HA) 偶联,进而自组装成HPN纳米颗粒,解决了PPS水溶性较差的问题。HPN纳米颗粒具有较强的ROS清除能力,能够保护肠道菌群,如E. coli Nissle 1917(EcN)和E.coli K12,以及肠道上皮细胞免受ROS导致的损伤。为进一步提升HPN纳米粒的治疗潜力,作者将该纳米粒偶联到益生菌EcN表面,借助益生菌的肠道定植能力,有效递送HPN纳米粒到达肠道部位并延长其在肠道部位的滞留时间,达到持续的ROS清除效果。另外,针对益生菌在口服过程中易遭受胃酸及胆汁酸等的侵袭,导致益生菌存活率低,以及肠道的蠕动作用导致益生菌在肠道的滞留时间有限等问题,课题组前期设计开发了单宁酸和L100双层膜包裹策略,显著增强了益生菌对外界环境的耐受性以及对肠道黏膜的粘附作用,提升了益生菌的口服存活率及肠道滞留时间,相关成果发表于Nano Today, 2021, 41, 101291。在此基础上,本研究进一步开发了聚去甲肾上腺素 (NE) 膜包裹益生菌策略(NE-EcN),该NE膜形成物理屏障,保护益生菌抵抗环境侵袭,增强了益生菌的口服存活率;同时NE膜能模拟贻贝足蛋白的粘附作用,赋予益生菌较强的水环境肠道组织粘附能力,进一步延长益生菌在肠道的滞留时间。(图1)在小鼠结肠炎模型中,该策略能够有效缓解小鼠的体重减轻以及结肠组织损伤,减少中性粒细胞浸润,降低肠道ROS水平;同时该方法有效地增加了肠道菌群多样性及丰富度,减少病原菌增殖,增强了益生菌对肠道菌群的调节作用,显著增强了对结肠炎疾病的治疗效果。
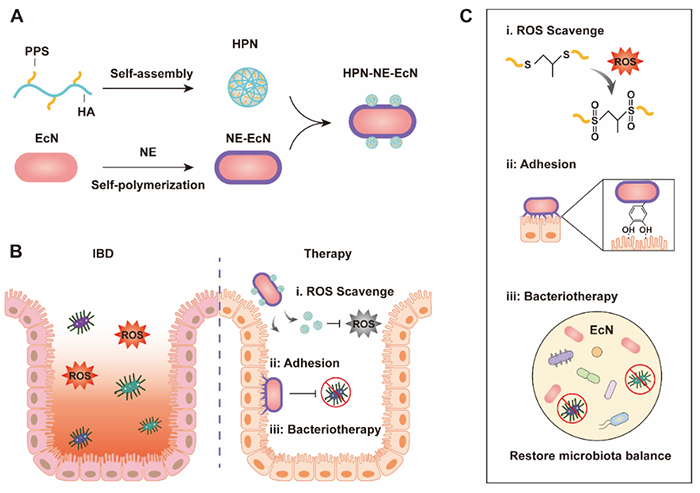
图1. HPN-NE-EcN的制备及其治疗炎症性肠病的机理示意图综上,在该研究中,胡教授课题组组合NE膜包裹的益生菌和具有ROS清除能力的HPN,构建了HPN-NE-EcN递药系统。该体系能够持续有效地清除ROS,降低肠道微环境中的ROS水平,保护肠道上皮细胞及肠道微生物免受ROS引发的损伤;同时NE膜能保护益生菌免受环境侵袭且延长了益生菌在肠道的滞留时间,增加肠道微生物多样性,抑制病原菌增殖,有效调节肠道菌群平衡,改善肠道微环境;在结肠炎小鼠模型中该递药体系展现了良好的治疗效果。该研究中,威斯康星大学麦迪逊分校的胡全银教授为文章的通讯作者,课题组博士后研究员刘军为文章第一作者。
原文链接:
http://doi.org/10.1126/sciadv.abp8798



